


| 専門及び担当業務 | |||
|---|---|---|---|
| 部長 | 山本 栄一 | [専門]分析化学、物理化学 [行政支援等]薬事・食品衛生審議会/医療機器・再生医療等製品安全対策部会委員、国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会委員、医薬品医療機器総合機構日本薬局方化学薬品委員会(1)/物性委員会委員/医療機器GLP専門委員会委員 [国際規格関連]ISO/TC 194(医療機器の生物学的評価)国内委員長、ISO/TC 106(歯科材料・機器)/WG 10委員 [教育関連]大阪大学連携大学院招へい教授(医療機器安全学)、昭和大学薬学部非常勤講師(薬剤学) [団体関連]日本歯科医師会歯科医療機器試験ガイドライン検討会委員、日本グローブ協会JIS原案作成委員会委員長、日本薬剤師会薬局製剤・漢方委員会委員 [学会関連]レギュラトリーサイエンス学会編集委員会委員、日本薬学会レギュラトリーサイエンス部会委員、日本薬剤学会編集委員会委員/薬剤学会核酸・遺伝子医薬フォーカスグループ幹事、クロマトグラフィー科学会評議員 |
|
| 期間業務職員 | 林 美和 | [担当業務]秘書業務 |
◎医療機器部の業務紹介

図1:医療機器部の業務概要

図2:医療機器部が実施している研究
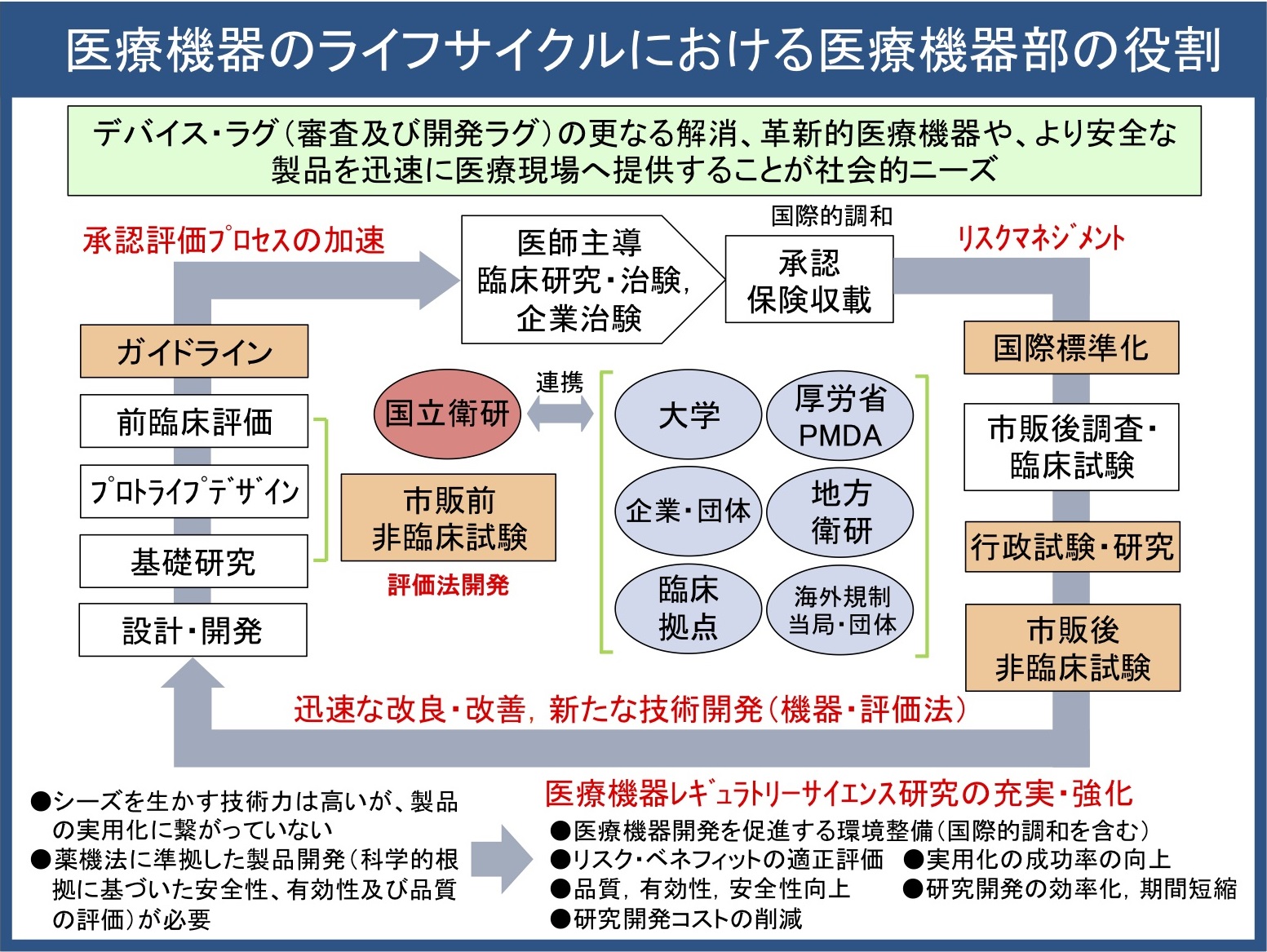
図3:医療機器ライフサイクルにおいて医療機器部が果たすべき役割