| ホーム | 各室の紹介 | 研究事業 | 行政支援 |
| 標準化関連活動 | 各種フォーラム | 研究業績 | 過去の情報 |
各室の紹介
部長室
スタッフ
山本 栄一
[専門]分析化学、物理化学、規制科学
[行政支援等]薬事・食品衛生審議会/医療機器・再生医療等製品安全対策部会委員、国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会委員、次世代医療機器・再生医療等製品評価指標検討会委員、医療機器開発ガイドライン評価検討委員会合同検討会委員、次世代医療機器・再生医療等製品評価指標作成事業 事務局等(厚労省)
日本薬局方物性委員会、日本薬局方注射用水ワーキンググループ座長、医薬品・医療機器GLP専門委員会、専門委員(PMDA)
[国際規格関連]ISO/TC 194(医療機器の生物学的評価)国内委員長、ISO/TC 106(歯科材料・機器)/WG 10委員
[教育関連]大阪大学連携大学院招へい教授(医療機器安全学)、昭和医科大学臨床薬理研究所創剤学客員教授
[団体関連]日本歯科医師会歯科医療機器試験ガイドライン検討会委員、日本グローブ協会JIS原案作成委員会委員長
[学会関連]レギュラトリーサイエンス学会編集委員会委員長、日本薬学会レギュラトリーサイエンス部会委員、クロマトグラフィー科学会評議員、バイオメディカル分析科学シンポジウム世話人
林 美和
[担当業務]事務補助
医療機器部の業務紹介
1. 医療機器のレギュラトリーサイエンス
新たなコンセプトや技術を取り入れた革新的医療機器に対する評価手法や指標には、未解明の部分が残されていることがあります。このため、医療機器におけるレギュラトリーサイエンスには、医用材料や各種機器の特性を踏まえ、研究開発から市販後調査に至るまでの過程において、安全性・有効性・品質を科学的に予測・判断・評価する手法の開発が求められます。加えて、有用な医療機器および関連技術による医療のイノベーションを先導・支援する役割も担っています。
2. 医療機器部の主な業務(図1, 2)
当部では、医療機器および医用材料に関する研究を公正中立な立場で実施し、得られた科学的知見をもとに医療機器行政を支援しています。革新的医療機器の創出には、機器の特性に応じた的確な評価が不可欠です。近年では、科学技術の進歩や知見の蓄積に加え、動物福祉など社会的要請の高まりを背景に、時代に即した試験法・評価法の開発が強く求められています。
当部では、医療システムの持続的発展を支えるため、多様な医療機器の多面的評価に取り組むとともに、革新的機器の開発促進に資する研究を行っています。また、行政支援の一環として、評価指標の策定等にも携わっています。さらに、医療機器のライフサイクル(図3)の加速を目的に、産学官連携のもとで規格・基準の策定・標準化、医療機器開発支援ネットワークへの参画、研究開発支援、人材育成、広報・啓発活動なども推進しています。
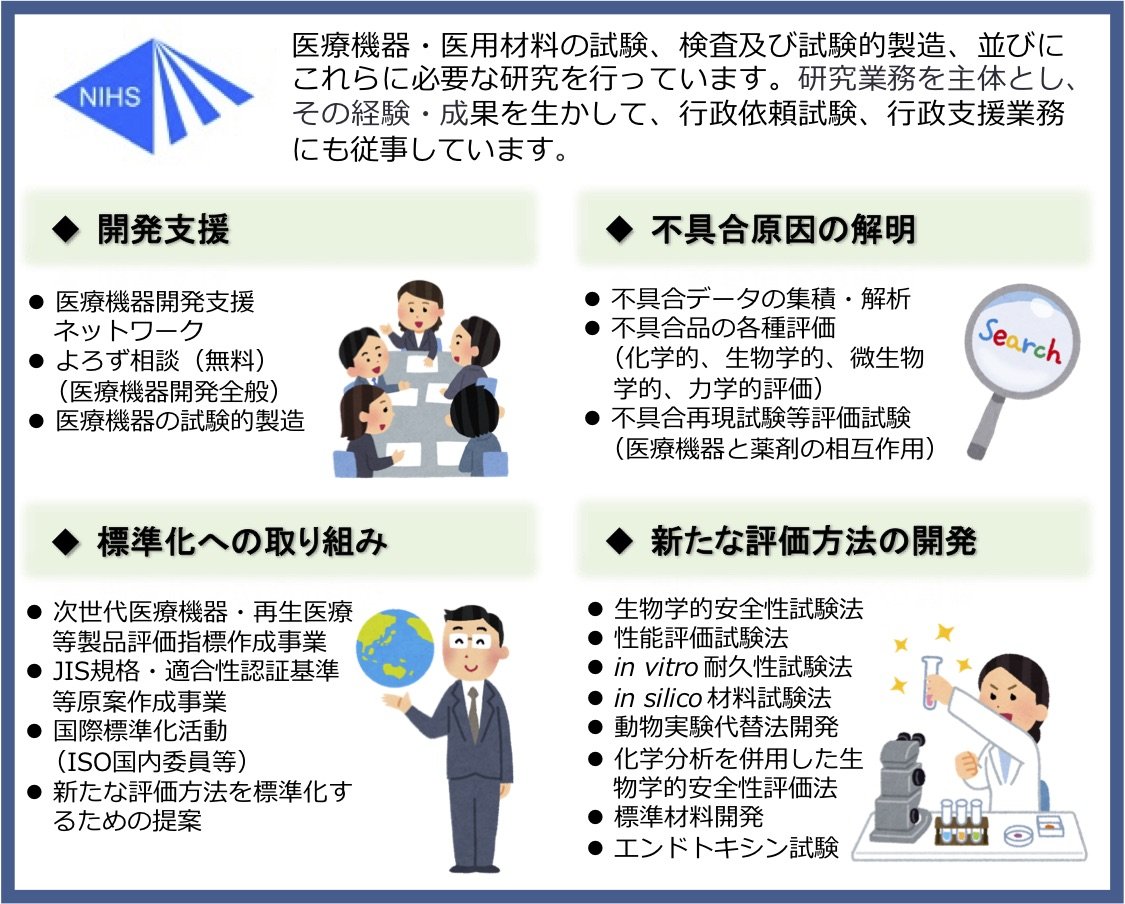
図1:医療機器部の業務概要

図2:医療機器部が実施している研究
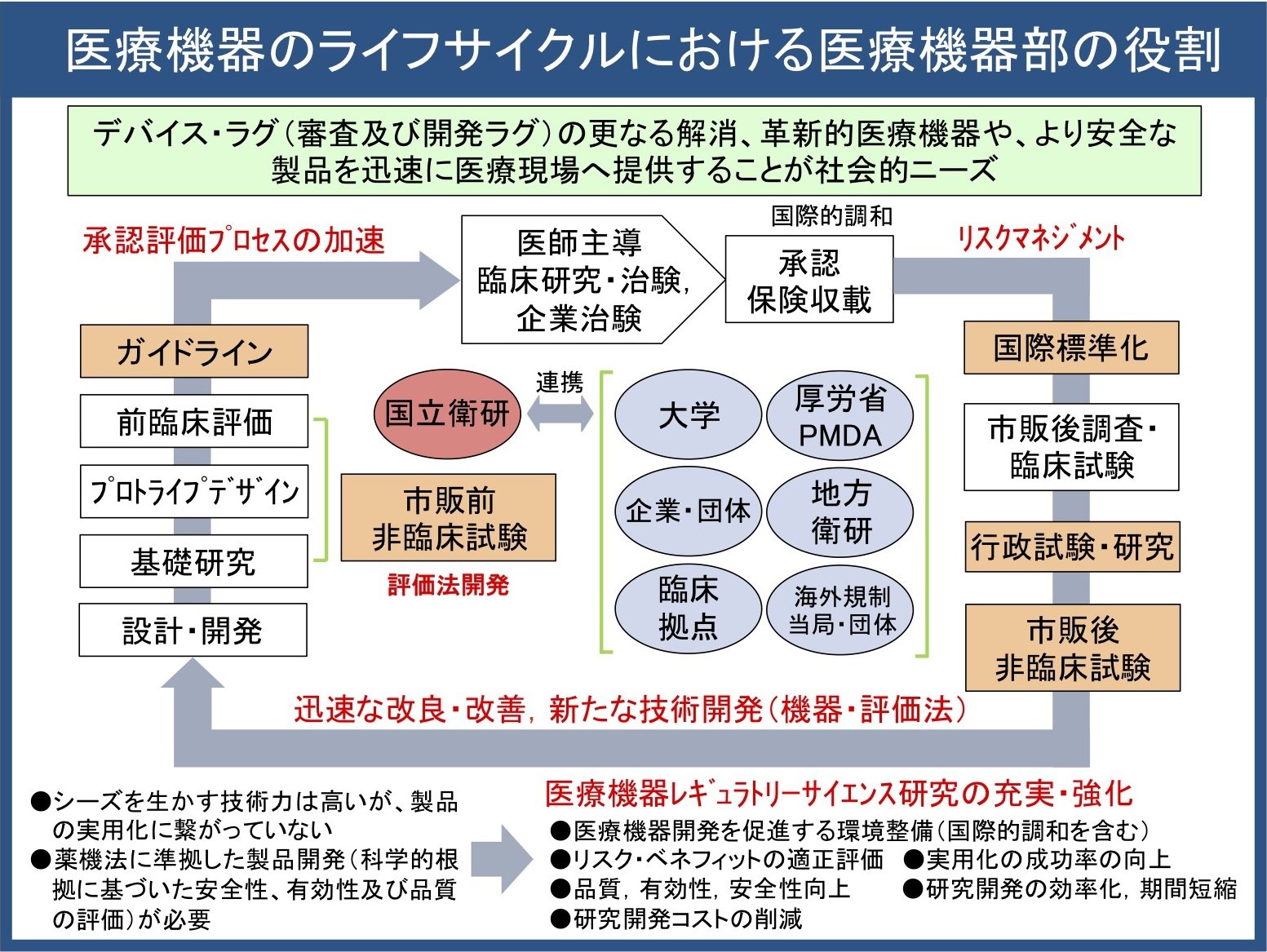
図3:医療機器ライフサイクルにおいて医療機器部が果たすべき役割
1. 新規試験法の開発
非臨床試験で得られる情報は、臨床試験で検証すべき内容を決定する上で重要です。非臨床段階でハザードが適切に検出され、リスクが推定されれば、臨床試験において観察すべき項目を明確化できます。すなわち、非臨床試験は臨床試験の設計において重要な役割を果たします。
当部では、化学的・生物学的・力学的な安全性評価法の開発・改良に取り組んでおり、これらの多くは医療機器全般に適用可能なホリゾンタルな試験法です。しかし、新技術を用いて製造された機器では、従来の試験法が適用できない場合もあるため、必要に応じて製品群に特化した試験系の開発も行っています。これには、実臨床を模した性能試験法や、動物実験では評価が難しいパラメータを検出可能な試験法も含まれます。
2. 規格・基準等の策定と国際標準化
革新的医療機器の開発促進および薬事審査の迅速化を図る国家的施策の一環として、医療機器の品質・有効性・安全性を科学的根拠に基づいて評価するためのガイドラインや評価指標、承認・認証基準の整備が進められています。あわせて、海外展開を視野に入れた国際標準化の推進も重要です。
当部では、次世代医療機器・再生医療等製品の評価指標作成事業や国際標準獲得促進事業などを通じ、評価指標・ガイドラインの策定およびその国際標準化に取り組んでいます。承認・認証基準については、国際的な基準との整合を図りつつ合理化を推進し、新規規格の提案・改訂も行っています。これにより、日本の優れた医療機器がグローバル市場で流通するための戦略的基盤を築いています。
3. オールジャパンによる医療機器開発への関与
健康・医療戦略推進会議のもと、「次世代医療機器開発推進協議会」によって構築された「医療機器開発支援ネットワーク」は、内閣官房、経済産業省、文部科学省、厚生労働省などの関係省庁と連携し、開発初期段階から事業化に至るまで切れ目のない支援を提供する施策です。当部も、厚生労働省の支援機関としてこの取り組みに参画し、医療機器開発の加速に貢献しています。
4. 産官学連携体制の強化
上記の「医療機器開発支援ネットワーク」は、関係府省(内閣官房、経済産業省、文部科学省、厚生労働省)や関連機関、企業、地域支援機関等が連携し、伴走コンサルとして開発初期段階から事業化に至るまで、開発段階に応じた切れ目のない支援を提供する施策です。医療機器促進法基本計画においても重点的に推進すべき事項として明記されています。当部は、厚生労働省の支援機関の一つとして、産官学連携による体制強化にも積極的に取り組んでいます。
5. 医療機器開発よろず相談
医療機器開発の円滑な推進に向け、PMDAは開発初期段階から各種相談に応じています。また、医療機器開発支援ネットワークでも広く相談を受け付けていますが、当部では、これらの支援体制が整う以前から開発に関する各種相談に対応してきました。PMDAの事前相談前の段階においても、薬事関連の不明点や疑問点、注意事項など、幅広い相談を無償で受け付けています。
ただし、当部の「よろず相談」は、薬事の一般的な考え方を提供するものであり、厚生労働省またはPMDAによる公式見解とは異なる可能性があることをご承知ください。確実な判断を得るには、最終的には規制当局への照会をお願いします。相談をご希望の方は、<こちら>からお申し込みください。
6. その他の取り組み
医療機器及び医用材料の安全性評価に関する研究では、製品開発に繋がる知見が得られる場合もあることから、開発の萌芽を見逃すことなく、医療機器の改良や試験的製造に関する業務も推進しています。また、人材育成、行政試験に関する地方衛研との連携・技術移譲、講演会や学会オーガナイズドセッションの企画・開催、並びに啓発活動等も行っています。
